Dra Vanessa L. Romanelli Tavares
Dr Leandro Ucela Alves
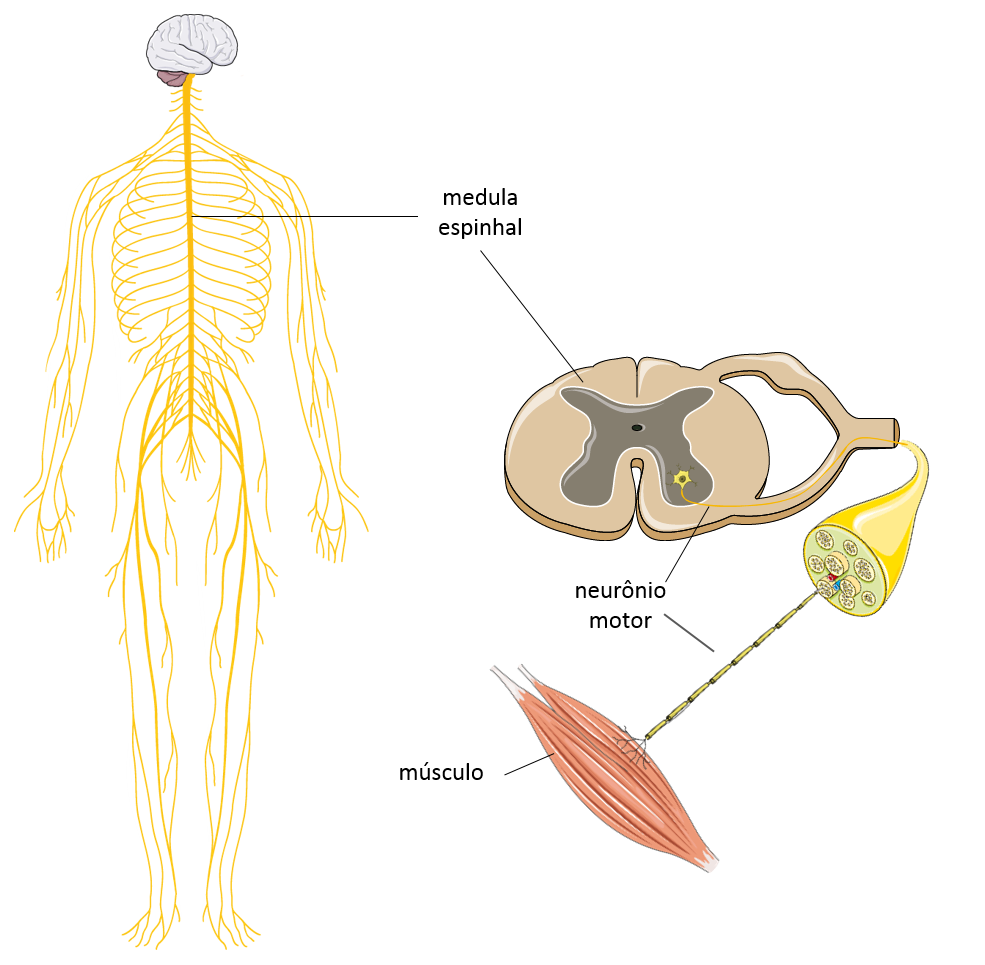 A Atrofia Muscular Espinhal (AME) é uma doença genética, hereditária, que atinge 1 a cada 10.000 recém-nascidos no mundo. A AME causa fraqueza e atrofia muscular devido à perda de neurônios motores, na medula espinhal, que controlam os movimentos. Há uma grande variabilidade na idade de aparecimento dos sintomas, no quadro clínico dos pacientes e na progressão da doença, fazendo com que a AME seja classificada em 5 tipos. Diversos fatores genéticos e não-genéticos têm sido estudados para explicar essas diferenças entre os pacientes.
A Atrofia Muscular Espinhal (AME) é uma doença genética, hereditária, que atinge 1 a cada 10.000 recém-nascidos no mundo. A AME causa fraqueza e atrofia muscular devido à perda de neurônios motores, na medula espinhal, que controlam os movimentos. Há uma grande variabilidade na idade de aparecimento dos sintomas, no quadro clínico dos pacientes e na progressão da doença, fazendo com que a AME seja classificada em 5 tipos. Diversos fatores genéticos e não-genéticos têm sido estudados para explicar essas diferenças entre os pacientes.
Os cuidados com as pessoas que tem AME devem ser contínuos e incluem fisioterapia motora e respiratória, suporte ortopédico, nutricional, gastrointestinal, social, educacional e aconselhamento genético*. Dado o grande impacto da AME na vida dos pacientes e familiares, a comunidade científica tem investido grande esforço na busca por tratamentos que visem aumentar a qualidade e a expectativa de vida das pessoas com a doença.
Diversas abordagens de terapia gênica estão sendo pesquisadas e têm por objetivo, em linhas simplificadas, aumentar a produção da proteína SMN, a qual está ausente nos pacientes com AME. Recentemente, uma dessas terapias gênicas foi aprovada pelo FDA, nos EUA, e pelo EMA, na União Europeia - órgãos equivalentes à ANVISA aqui no Brasil. A ANVISA é responsável, dentre outros, pela regulamentação do registro de medicamentos no país. Em 02 de Maio deste ano, o pedido de avaliação dessa terapia foi protocolado na ANVISA e encontra-se em fase de avaliação dos documentos, de acordo com a última notificação dada pelo órgão nacional.
Atualmente, além da preocupação com a liberação da comercialização do medicamento no Brasil, o custo exorbitante da terapia preocupa profissionais e pacientes: o gasto estimado é de aproximadamente R$ 2,4 milhões no primeiro ano e R$ 1,2 milhões nos anos consecutivos, por paciente. Ainda, o medicamento deverá passar pela avaliação de órgãos competentes para que possa ser incorporado e fornecido pelo SUS. “Este é o momento de nos unirmos para que quando houver a aprovação de uma terapia para a AME, pela ANVISA, possamos ter as melhores ferramentas em mãos para garantir uma rápida e eficiente maneira de incorporá-la ao SUS. Assim, vamos garantir que todos os pacientes, que puderem se beneficiar do tratamento, possam ser contemplados” – diz Mayana Zatz, coordenadora do Centro de Pesquisas sobre o Genoma Humano e Células-Tronco (CEGH-CEL) da USP.
É importante ressaltar que é necessário avaliar quais pacientes poderão ter reais benefícios com a administração de uma determinada terapia gênica, uma vez que elas podem depender do tipo de mutação que a pessoa apresenta. A Dra Karina Weinmann, neurologista infantil do CEGH-CEL, reforça que “O acompanhamento médico é imprescindível para monitorar as condições clínicas do paciente antes de receber a medicação, bem como sua evolução durante e após a administração, sempre atento a possíveis efeitos colaterais”. No caso da AME tipo I, a progressão da doença é muito rápida e o óbito precoce. Portanto, a aprovação de uma terapia que possa melhorar a qualidade e a expectativa de vida deve ser analisada com a maior urgência.
Ambos os autores são PhD em Ciências-Genética, pela Universidade de São Paulo e, atualmente, desenvolvem projetos de pesquisa no Centro de Estudos sobre o Genoma Humano e Células-Tronco da USP.
Legenda:
*Aconselhamento Genético: trata-se de uma consulta com um geneticista, na qual será realizada orientação para testes genéticos de confirmação do quadro clínico (quando aplicado), fornecidas informações sobre a doença genética - como sintomas, evolução e possíveis tratamentos oferecidos pela medicina atual – e a orientação para o planejamento familiar (incluindo informações sobre o risco de ocorrência ou recorrência da doença na família).
FDA - Food and Drug Administration
EMA - European Medicines Agency’s
ANVISA - Agência Nacional de Vigilância Sanitária
Referências:
Pierro, Revista FAPESP. Fev/2017.
Farrar et al., Ann Neurol. 2017.
Wirth, Hum. Mutat. 2000.
ANVISA
FDA
EMA


